Podríamos definirlo como la fuerza que mantiene unidos a los átomos en una molécula. Se puede expresar gráficamente de la siguiente manera:
En química, un dato experimental importante es que sólo los gases nobles y los metales en estado de vapor se presentan en la naturaleza como átomos aislados, en la mayoría de los materiales que nos rodean los elementos están unidos por enlaces químicos.
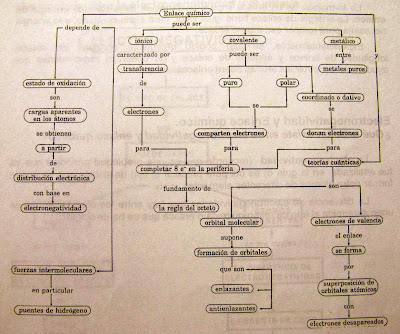
Enlace significa unión, un enlace químico es la unión de dos o más átomos con un solo fin, alcanzar la estabilidad, tratar de parecerse al gas noble más cercano. Para la mayoría de los elementos se trata de completar ocho electrones en su último nivel.
Las fuerzas atractivas que mantienen juntos los elementos que conforman un compuesto, se explican por la interacción de los electrones que ocupan los orbitales más exteriores de ellos (electrones de valencia).
Cuando dos átomos se acercan se ejercen varias fuerzas entre ellos. Algunas de estas fuerzas tratan de mantenerlos unidos, otras tienden a separarlos.
En la mayoría de los átomos, con excepción de los gases nobles (muy estables, con su última capa o nivel de energía completo con sus ocho electrones), las fuerzas atractivas son superiores a las repulsivas y los átomos se acercan formando un enlace.
 |
| Gases nobles |
Así, podemos considerar al enlace químico como la fuerza que mantiene unidos a dos o más átomos dentro de una molécula.
Todos los enlaces químicos resultan de la atracción simultánea de uno o más electrones por más de un núcleo.
Electrones de Valencia
En la mayoría de los átomos, muchos de los electrones son atraídos con tal fuerza por sus propios núcleos que no pueden interaccionar de forma apreciable con otros núcleos. Sólo los electrones que ocupan los niveles de energía más alejados del núcleo de un átomo pueden interaccionar con dos o más núcleos. A éstos se les llama electrones de valencia.
La unión consiste en que uno o más electrones de valencia de algunos de los átomos se introduce en la esfera electrónica del otro.
El número de electrones de valencia de un átomo es igual al número de su familia o grupo (que corresponden a las 18 divisiones verticales) en la tabla periódica, usando sólo la antigua numeración romana.
Así, tenemos un electrón de valencia para los elementos de los grupos IA (o grupo 1) y IB (o grupo 11); dos electrones de valencia para los elementos de los grupos IIA y IIB (o grupos 2 y 12), y cuatro para los elementos de los grupos IVB y IVA (o grupos 4 y 14).
Todos los átomos de los gases nobles (o sea: neón, argón, criptón, xenón y radón) tienen ocho electrones de valencia, excepto el helio, que tiene dos. Los elementos de las familias (grupos) cercanas a los gases nobles tienden a reaccionar para adquirir la configuración de ocho electrones de valencia de los gases nobles.
Esta configuración electrónica de los gases nobles les comunica inactividad química y una gran estabilidad.
Esto se conoce como la regla del octeto de Lewis, que fue enunciada por el químico estadounidense Gilbert N. Lewis.
Regla del octeto
Los átomos tienden a perder, ganar o compartir electrones en forma tal que queden con un total de 8 electrones en su nivel energético más exterior, semejante a la de un gas noble (ocho electrones), esta configuración les proporciona gran estabilidad.
Estructura o Notación de Lewis
La notación o estructura de Lewis es una representación gráfica que muestra la cantidad de electrones de valencia que hay en el último orbital.
La estructura de Lewis fue propuesta por Gilbert Lewis, la cantidad de electrones de valencia se representan con puntos alrededor del elemento químico (símbolo), por ejemplo:


.gif)