Energía natural en
la Tierra
Casi toda la
energía que impulsa la vida, el tiempo, el clima y los procesos naturales en la
superficie terrestre provienen del sol. La vida en la Tierra no sería posible
sin él. Y esto no significa sólo la vida en la playa.
Sólo una diminuta
fracción de la energía que tiene influencia en nuestro ambiente, se origina en
la parte interior líquida de la Tierra. Esta energía, la cual está todavía
presente desde la formación de nuestro planeta, es utilizada, por ejemplo, en
compresores geotérmicos. Durante erupciones volcánicas la energía se muestra de
una manera natural. El sistema del Clima y el cambio climático provocado por el
hombre no tienen ninguna influencia en los procesos dentro de la Tierra,
tampoco en erupciones volcánicas ni en terremotos. Si personas mueren debido a
terremotos o erupciones volcánicas, el cambio climático no es responsable
de ello.
La radiación del Sol
El Sol transfiere su energía por medio de ondas electromagnéticas como
la luz. Pero a menudo pensamos que la luz (que podemos ver con nuestros ojos)
es la única parte de la radiación emitida por el sol.
Esta figura muestra el espectro original de la radiación solar
idealizada (amarillo), en el tope superior de la atmósfera (naranja) y en la
superficie terrestre después de ser modificada por la atmósfera (multicolor,
negro). Las áreas negras representan la luz, que no es visible por nuestros
ojos. La energía de la radiación disminuye de izquierda a derecha. © Wikimedia Creative Commons Lincence
El Sol también transfiere energía aún más
energética que la luz visible, como la radiación ultra violeta (UV). Demasiada
luz UV daña las células de plantas, de humanos y de animales. Afortunadamente,
la capa de ozono en una altitud de 15-40 km absorbe una importante fracción de
esta radiación sumamente energética y peligrosa.
El Sol
también emite la radiación térmica con una energía más baja que la luz visible,
la cual llamamos luz infrarroja o radiación infrarroja. Nosotros la
sentimos como ‘calor’ en la piel, semejante a la radiación invisible del calor
de un plato caliente.
La radiación del Sol corre a una velocidad increíble de 300.000 km/s (velocidad luz) por el espacio y recorre una distancia de 150 millones de kilómetros del Sol a la Tierra en aproximadamente 8 minutos.
La radiación del Sol corre a una velocidad increíble de 300.000 km/s (velocidad luz) por el espacio y recorre una distancia de 150 millones de kilómetros del Sol a la Tierra en aproximadamente 8 minutos.
Cantidad de energía
transferida
Las cantidades de energía son medidas en Joules o Julios. El Sol
transfiere en cada segundo la cantidad de 1367 J en cada metro cuadrado del
diámetro de la Tierra. Esto corresponde a una potencia de 1367 W (vatios o
watts) [1 Vatio = 1 Joule por segundo]. Este valor recibe el nombre de
"constante solar".
Por dos razones esta energía no alcanza continuamente cada metro cuadrado de la superficie terrestre. Las razones son: 1) la geometría de la Tierra 2) la influencia de la atmósfera.
Por dos razones esta energía no alcanza continuamente cada metro cuadrado de la superficie terrestre. Las razones son: 1) la geometría de la Tierra 2) la influencia de la atmósfera.
La
superficie terrestre "S" se aproxima a la superficie de una esfera
con radio "r" y su área es:
El
área que es golpeada verticalmente por el Sol es sólo la sección circular
transversal "D" de esta esfera con un área de:
La
Geometría de la Tierra: La Tierra no es un disco frente al Sol sino una esfera.
Por lo tanto, el sol no irradia a la Tierra verticalmente sino que en la
mayoría de las regiones lo hace con un cierto ángulo. Cuando es de noche de un
lado de la Tierra, no hay irradiación alguna. La sección transversal de una
esfera, que es golpeada verticalmente por el sol, es sólo un cuarto de su
superficie. Por lo tanto alcanza sólo ¼ x 1367 Vatios = 342 vatios por
metro cuadrado de la atmósfera superior.
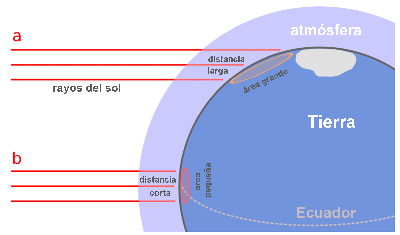
La
energía transferida por los rayos paralelos del sol a la Tierra es la
misma, pero dependiendo del ángulo de incidencia, el área impactada es diferente.
Así mismo ocurre con la atmósfera, de tal manera que los rayos llegan a ser más
débiles mientras más grande sea la porción de atmósfera.
© GNU Licence Wikipedia, modificada
© GNU Licence Wikipedia, modificada
La luz del sol no puede pasar
la atmósfera y alcanzar la superficie de la Tierra sin trabas. Las nubes, el
hielo y áreas nevadas lo reflejan. Los gases y el polvo en el aire toman la
energía y remiten en todas direcciones, también de regreso al espacio. Al
final, aproximadamente 168 Vatio de un promedio de 342 Vatio son absorbidos por
la Tierra.
Pero, en comparación, sólo
cerca de 0.06 W/m2 viene como radiación térmica del interior de
la tierra. Esto es más de 2000 veces menos que el poder del Sol.
La distribución de la energía
Sabemos que el clima cercano al ecuador es más cálido que en el Polo Norte o en el Polo Sur. Nosotros también sabemos que en todas partes de la Tierra el verano es más cálido que el invierno. La energía del Sol no se esparce uniformemente en todas las regiones del mundo. También cambia con la temporada, debido a que el eje de la Tierra esta inclinado a un ángulo de aproximadamente 23,3 °.
La distribución de la energía
Sabemos que el clima cercano al ecuador es más cálido que en el Polo Norte o en el Polo Sur. Nosotros también sabemos que en todas partes de la Tierra el verano es más cálido que el invierno. La energía del Sol no se esparce uniformemente en todas las regiones del mundo. También cambia con la temporada, debido a que el eje de la Tierra esta inclinado a un ángulo de aproximadamente 23,3 °.