Evolución de la Tabla periódica
Aunque Dmitri Mendeleiev es considerado a menudo el "padre" de la tabla periódica, su estructura actual es el fruto del trabajo de muchos científicos.
Los orígenes:
Un requisito previo necesario a la construcción de la tabla periódica era el descubrimiento de los elementos individuales. Aunque elementos como oro, plata, estaño, cobre, plomo y mercurio eran conocidos desde la antigüedad, el primer descubrimiento científico de un elemento tuvo lugar en 1669 cuando Hennig Brand descubrió el fósforo.
Durante los siguientes 200 años, se adquirió un gran conocimiento sobre las propiedades de los elementos y de sus compuestos. En 1869, habían sido descubiertos un total de 63 elementos. Como el número de elementos conocidos iba creciendo, los científicos empezaron a buscar patrones en sus propiedades y a desarrollar esquemas para su clasificación.
Ley de las tríadas
En 1817 Johann Dobereiner observó que el peso atómico del estroncio era aproximadamente la media entre los pesos del calcio y del bario, elementos que poseen propiedades químicas similares.
En 1829, tras descubrir la tríada de halógenos compuesta por cloro, bromo y yodo, y la tríada de metales alcalinos litio, sodio y potasio, propuso que en la naturaleza existían tríadas de elementos de forma que el central tenía propiedades que eran un promedio de los otros dos miembros de la tríada (la Ley de Tríadas).
Esta nueva idea de tríadas se convirtió en un área de estudio muy popular. Entre 1829 y 1858 varios científicos (Jean Baptiste Dumas, Leopold Gmelin, Ernst Lenssen, el von de Max Pettenkofer, y J.P. Cooke) encontraron que estos tipos de relaciones químicas se extendían más allá de las tríadas.
Durante este tiempo se añadió el flúor al grupo de los halógenos; se agruparon oxígeno, azufre, selenio y teluro en una familia mientras que nitrógeno, fósforo, arsénico, antimonio y bismuto fueron clasificados en otra.
Las investigaciones llevadas a cabo presentaban la dificultad de que no siempre se disponía de valores exactos para las masas atómicas y se hacía difícil la búsqueda de regularidades.
El tornillo telúrico
Primeros intentos de diseño de una tabla periódica:
Si una tabla periódica se considera como una clasificación de los elementos químicos que demuestran la periodicidad de las propiedades físicas y químicas, habría que atribuir la primera tabla periódica (publicada en 1862) al geólogo francés, A.E. Beguyer de Chancourtois.
De Chancourtois dispuso los elementos según el orden creciente de sus pesos atómicos sobre una curva helicoidal en el espacio, de manera que los puntos que se correspondían sobre las sucesivas vueltas de la hélice, diferían en 16 unidades de peso atómico. Los elementos análogos, estaban situados en tales puntos, lo que sugería una repetición periódica de las propiedades. Esta disposición se conoce como tornillo telúrico.
Esto llevó a Chancourtois a proponer que las propiedades de los elementos son las propiedades de los números. De Chancourtois fue el primero en observar que las propiedades se repetían cada siete elementos, y usando esta representación pudo predecir la estequiometría de varios óxidos metálicos. Desgraciadamente, incluyó en su clasificación algunos iones y compuestos además de los elementos.
Ley de las Octavas
John Newlands, un químico inglés, redactó un trabajo en 1863 en el que clasificaba los 56 elementos estableciendo 11 grupos basados en propiedades físicas similares y mencionaba que en muchos pares de elementos similares existían diferencias en la masa atómica relacionadas con algún múltiplo de ocho.
En 1864 Newlands publicó su versión de la tabla periódica y propuso la Ley de las Octavas (por analogía con los siete intervalos de la escala musical). Esta ley establecía que un elemento dado presentaría unas propiedades análogas al octavo elemento siguiendo la tabla.
Meyer y Mendeleiev
¿Quién es creador de la tabla periódica?
Ha habido alguna discordancia sobre quién merece ser reconocido como creador de la tabla periódica, si el alemán Lothar Meyer o el ruso Dmitri Mendeleiev.
Trabajando independientemente, ambos químicos produjeron resultados notablemente similares y casi al mismo tiempo. Un libro de texto de Meyer publicado en 1864 incluía una versión abreviada de una tabla periódica para clasificar los elementos. La tabla comprendía la mitad de los elementos conocidos organizados en orden de su masa atómica y mostraba una periodicidad en función de ésta.
En 1868, Meyer construyó una tabla extendida que entregó a un colega para su evaluación. Desgraciadamente para Meyer, la tabla de Mendeleiev se publicó en 1869, un año antes de que apareciera la de Meyer.
Dmitri Ivanovich Mendeleiev (1834-1907), el menor de 17 hermanos, nació en el pueblo Siberiano de Tobolsk donde su padre era profesor de literatura rusa y filosofía (Mendeleiev en 1904).
Mendeleiev no fue considerado un buen estudiante en su juventud en parte debido a su aversión por las lenguas clásicas, que eran un requisito educativo importante en aquel momento, aunque sí mostró destreza para las matemáticas y la ciencia.
Tras la muerte de su padre, se trasladó a S. Petersburgo para estudiar en la universidad, graduándose en 1856. Mendeleiev impresionó tanto a sus instructores que le fue ofrecido un puesto para enseñar química. Tras pasar los años 1859 y 1860 en Alemania ampliando sus estudios retornó a su puesto de profesor en el que estuvo hasta 1890.
En este periodo escribió un libro de texto sobre química inorgánica, Principios de Química, que tuvo trece ediciones (la última en 1947) en el que organizaba los elementos conocidos en familias que presentaban propiedades similares. La primera parte del texto se consagró a la química, bien conocida, de los halógenos.
Luego, comenzó con la química de los elementos metálicos ordenándolos según su poder de combinación: metales alcalinos primero (poder de combinación de uno), los alcalinotérreos (dos), etc. Sin embargo, era difícil clasificar metales como cobre y mercurio que a veces presentaban valor 1 y otras veces 2.
Mientras intentaba buscar una salida a este dilema, Mendeleiev encontró relaciones entre las propiedades y los pesos atómicos de los halógenos, los metales alcalinos y los metales alcalinotérreos, concretamente en las series Cl-K-Ca, Br-Rb-Sr y I-Cs-Ba. En un esfuerzo por generalizar este comportamiento a otros elementos, creó una ficha para cada uno de los 63 elementos conocidos en la que presentaba el símbolo del elemento, su peso atómico y sus propiedades físicas y químicas características.
Cuando Mendeleiev colocó las tarjetas en una mesa en orden creciente de pesos atómicos disponiéndolas como en un solitario quedó formada la tabla periódica. En 1869 desarrolló la ley periódica y publicó su trabajo Relación de las Propiedades de los Elementos y sus Pesos Atómicos. La ventaja de la tabla de Mendeleiev sobre los intentos anteriores de clasificación era que no sólo presentaba similitudes en pequeños grupos como las tríadas, sino que mostraba similitudes en un amplio entramado de relaciones verticales, horizontales, y diagonales.
En el momento que Mendeleiev desarrolló su tabla periódica, las masas atómicas experimentalmente determinadas no siempre eran exactas, y reordenó de nuevo los elementos a pesar de sus masas aceptadas. Por ejemplo, cambió el peso del berilio de 14 a 9. Esto colocó al berilio en el Grupo 2 encima del magnesio cuyas propiedades se parecían más que donde se había colocado antes (encima del nitrógeno).
En total Mendeleiev tuvo que mover 17 elementos a nuevas posiciones para poner sus propiedades en correlación con otros elementos. Estos cambios indicaron que había errores en los pesos atómicos aceptados de algunos elementos y se rehicieron los cálculos para muchos de ellos.
Sin embargo, aún después de que las correcciones fueron hechas, algunos elementos todavía necesitaron ser colocados en un orden diferente del que se deducía de sus pesos atómicos. A partir de los huecos presentes en su tabla, Mendeleiev predijo la existencia y las propiedades de elementos desconocidos que él llamó eka-aluminio, eka-boro, y eka-silicio.
Más tarde se descubrieron el galio, el escandio y el germanio coincidiendo con sus predicciones. Además del hecho que la tabla de Mendeleiev se publicó antes que la de Meyers, su trabajo era más extenso, prediciendo la existencia de otros elementos no conocidos en ese momento.
Un nuevo grupo de elementos
Descubrimiento de los Gases Nobles
En 1895 Lord Rayleigh informó del descubrimiento de un nuevo elemento gaseoso, llamado argón, que resultaba ser químicamente inerte. Este elemento no encajaba en ninguno de los grupos conocidos de la tabla periódica.En 1898, William Ramsey sugirió que el argón se colocara entre el cloro y el potasio en una familia con el helio, a pesar del hecho de que el peso atómico del argón era mayor que el del potasio. Este grupo fue llamado "grupo cero" debido a la valencia cero de estos elementos. Ramsey predijo con precisión el descubrimiento futuro del neón y sus propiedades.
El número atómico como criterio de ordenación
La estructura atómica y la tabla periódica
Aunque la tabla de Mendeleiev demostró la naturaleza periódica de los elementos, la explicación de por qué las propiedades de los elementos se repiten periódicamente tuno que esperar hasta el siglo XX.
En 1911 Ernest Rutherford publicó sus estudios sobre la emisión de partículas alfa por núcleos de átomos pesados que llevaron a la determinación de la carga nuclear. Demostró que la carga nuclear en un núcleo era proporcional al peso atómico del elemento.
También en 1911, A. van der Broek propuso que el peso atómico de un elemento era aproximadamente igual a la carga. Esta carga, más tarde llamada número atómico, podría usarse para numerar los elementos dentro de la tabla periódica.
En 1913, Henry Moseley publicó los resultados de sus medidas de las longitudes de onda de las líneas espectrales de emisión de rayos X observando que la ordenación de los elementos por estas longitudes de onda coincidía con la ordenación obtenida con el criterio de los números atómicos.
Con el descubrimiento de isótopos de los elementos, se puso de manifiesto que el peso atómico no era el criterio que marcaba la ley periódica como Mendeleiev, Meyers y otros habían propuesto, sino que las propiedades de los elementos variaban periódicamente con número atómico.
La pregunta de por qué la ley periódica existe se contestó gracias al conocimiento y comprensión de la estructura electrónica de los elementos que comenzó con los estudios de Niels Bohr sobre la organización de los electrones en capas y con los descubrimientos de G.N. Lewis sobre los enlaces de pares de electrones.
Descubrimiento
La tabla periódica moderna
Los últimos cambios importantes en la tabla periódica son el resultado de los trabajos de Glenn Seaborg a mediados del siglo XX, empezando con su descubrimiento del plutonio en 1940 y, posteriormente, el de los elementos transuránidos del 94 al 102.
Seaborg, premio Nobel de Química en 1951, reconfiguró la tabla periódica poniendo la serie de los actínidos debajo de la serie de los lantánidos.
En las tablas escolares suele representarse el símbolo, el nombre, el número atómico y la masa atómica de los elementos como datos básicos y, según su complejidad, algunos otros datos sobre los elementos.
Bloque "s": La configuración electrónica externa es ns1 ns2, formado por H y los grupos IA y IIA de los elementos representativos.
Bloque "p": La configuración electrónica externa es ns2npx, donde x varía entre 1 y 6. Formado por los grupos IIIA, IVA, VA, VIA, VIIA y VIIIA de los elementos representativos.
Bloque "d": La configuración electrónica finaliza en un subnivel d; formado por todos los elementos de transición, grupos IB al VIIIB, (3 a 12)
Bloque "f": La configuración electrónica finaliza en un subnivel f, formado por todos los elementos de transición interna.
Descripción de la Tabla Periódica
Los elementos se hallan distribuidos:
- En 7 filas denominadas Periodos.
- En 18 columnas o familias, las cuales se ordenan en grupos: 8 grupos A y 8 grupos B.
Períodos:
- Son las filas horizontales.
- Nos indica el último nivel de energía del elemento.
- Existen 7 periodos o niveles.
Grupos:
- Son agrupaciones verticales.
- Nos indican que poseen propiedades químicas semejantes debido a que poseen los mismos electrones de valencia.
- En la tabla periódica están ordenados en grupos A y B.
Grupo A:
- Están situados a los extremos de la tabla periódica.
- Nos indican el número de electrones de la última capa y se presentan en números romanos.
- Terminan en el subnivel “s” y “p”.
Grupo B
- Están situados en la zona central de la tabla periódica.
- El número de electrones de la última capa no nos indica el grupo; debido a que la valencia es variable.
- La configuración electrónica termina en el subnivel “d”.
- Los elementos de transición interna: llamados tierras raras, su configuración electrónica termina en “f”
- Tienen 8 grupos. El grupo VIIIB tiene 3 casilleros.
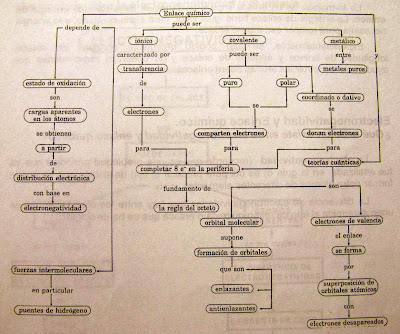
 Ejercicio: Establece la estructura de Lewis para los elementos: Li, B, O y N.La reactividad de un elemento depende, en términos generales, de cuántos electrones tenga para completar su configuración electrónica, o sea para alcanzar la configuración de cualquier gas noble, es decir con todos los orbitales completos. De acuerdo a ello, y para simplificar la cuenta de electrones, cualquier átomo que tenga orbitales p incompletos debe cumplir con la regla del octeto,es decir ocho electrones en su último nivel. Para el H y He se cumple con la regla de dueto: dos electrones en el último nivel. El enlace químico es el resultado de las interacciones atractivas entre los núcleos atómicos y los electrones, que superan energéticamente a las interacciones de repulsión de los electrones entre sí y también entre los núcleos. El modelo más simple es el enlace iónico. Para que un enlace sea iónico debe existir una apreciable diferencia de electronegatividad, de modo que uno de los átomos atraiga con más fuerza un electrón y ambos quedan cargados. De este modo, este modelo de enlace supone que ambos iones se comportan como cargas puntuales e interaccionan de acuerdo a la ley de Coulomb. Este tipo de enlaces es típico de moléculas formadas por un elemento del grupo 7A (halógenos) y un elemento del grupo 1A (alcalinos). Los halógenos son muy electronegativos porque les falta sólo un electrón para cumplir con la regla del octeto y alcanzar la configuración electrónica de un gas noble. Esto hace que atraigan un electrón del elemento alcalino. Los alcalinos tienen un electrón en la última capa, y lo liberan fácilmente para cumplir con la regla del octeto. Ambos elementos quedan cargados: el halógeno negativo y el alcalino, positivo:
Ejercicio: Establece la estructura de Lewis para los elementos: Li, B, O y N.La reactividad de un elemento depende, en términos generales, de cuántos electrones tenga para completar su configuración electrónica, o sea para alcanzar la configuración de cualquier gas noble, es decir con todos los orbitales completos. De acuerdo a ello, y para simplificar la cuenta de electrones, cualquier átomo que tenga orbitales p incompletos debe cumplir con la regla del octeto,es decir ocho electrones en su último nivel. Para el H y He se cumple con la regla de dueto: dos electrones en el último nivel. El enlace químico es el resultado de las interacciones atractivas entre los núcleos atómicos y los electrones, que superan energéticamente a las interacciones de repulsión de los electrones entre sí y también entre los núcleos. El modelo más simple es el enlace iónico. Para que un enlace sea iónico debe existir una apreciable diferencia de electronegatividad, de modo que uno de los átomos atraiga con más fuerza un electrón y ambos quedan cargados. De este modo, este modelo de enlace supone que ambos iones se comportan como cargas puntuales e interaccionan de acuerdo a la ley de Coulomb. Este tipo de enlaces es típico de moléculas formadas por un elemento del grupo 7A (halógenos) y un elemento del grupo 1A (alcalinos). Los halógenos son muy electronegativos porque les falta sólo un electrón para cumplir con la regla del octeto y alcanzar la configuración electrónica de un gas noble. Esto hace que atraigan un electrón del elemento alcalino. Los alcalinos tienen un electrón en la última capa, y lo liberan fácilmente para cumplir con la regla del octeto. Ambos elementos quedan cargados: el halógeno negativo y el alcalino, positivo:








.gif)